Unsur Halogen
Sesudah membahas
mengenai unsur alkali dan unsur alkali tanah. Sekarang saya akan membahas
mengenai unsur Halogen.
Apa itu unsur Halogen?
Unsur halogen
merupakan unsur-unsur nonlogam di mana terdapat dalam bentuk molekul diatomik.
Halogen, yang terdiri dari fluor, klor, brom, dan iod, tidak pernah ditemukan
dalam keadaan bebas di alam karena tingkat reaktifitasnya yang sangat tinggi.
Oleh karena itu, halogen hanya ditemukan sebagai anion dalam bentuk garam dan
mineral. Halogen mempunyai konfigurasi elektron valensi ns2 np5.
Sifat Halogen
Dalam keadaan standar
(tekanan 1 atm dan temperatur 25°C), Fluor adalah gas berwarna kekuningan, Klor
adalah gas berwarna hijau pucat, Brom adalah cairan berwarna merah
kecoklatan, dan Iod adalah padatan berwarna ungu-hitam. Tabel menampilkan
bahwa titik didih dan titik leleh naik seiring dengan bertambahnya nomor atom.
Hal ini karena fakta menunjukkan bahwa molekul-molekul yang lebih besar
mempunyai gaya tarik-menarik Van der Waals yang lebih besar
daripada yang dimiliki molekul-molekul yang lebih kecil. Halogen
mempunyai energi ionisasi dan elektronegatifitas yang paling tinggi dari
golongan unsur manapun kecuali gas mulia. Dari unsur golongan VII A, fluor
adalah yang paling erat mengikat elektron-elektronnya, dan iod yang paling
lemah. Kecenderungan ini bisa dikaitkan dengan ukuran atom halogen.
Energi ionisasi
menurun dalam satu golongan karena terpengaruhi oleh jari-jari atom yang
semakin besar dari Fluor sampai Iod, demikian halnya keelektronegatifan dan
potensial standar reduksi (E°red). Berikut adalah harga potensial
standar reduksi (E°red) masing-masing unsur Halogen:
Ini berarti, Flour paling
mudah tereduksi (oksidator kuat), sedangkan Iod paling sulit tereduksi
(oksidator lemah). Tetapi pada dasarnya Semua Halogen adalah oksidator yang
kuat.
Reaksi Unsur Halogen
Halogen bereaksi dengan hampir semanya non logam. Jenis
senyawa yang terbentuk sebagian besar adalah senyawa kovalen. Beberapa contoh reaksi halogen yang banyak ditemukan
senyawanya adalah hydrogen
halida atau biasa disebut asam halida jika dilarutkan dalam air dan non logam
halida (reaksi halogen dengan unsur-unsur
penting seperti O, P, C, maupun S)
Hydrogen halida
Hydrogen bereaksi dengan halogen membentuk
senyawa hydrogen halida yang semuanya adalah gas tidak berwarna. Persamaan reaksi halogen (X) dengan hydrogen
adalah sebagai berikut:
H2(g) + X2(g) → 2HX(g)
Contoh reaksi hydrogen dan halida adalah sebagai berikut:
Reaksi antara Hidrogen dan
Fluor : reaksi
berlangsung hebat.
H2 + F2 → 2HF
Reaksi antara hydrogen dan
Clor : reaksi berlangsung lambat di tempat gelap. Tetapi, jika
di bawah sinar matahari, akan terjadi ledakan.
H2 + Cl2 → 2HCl
Reaksi antara hydrogen dan Brom : reaksi berlangsung pada suhu 300oC
dan menggunakan katalis Pt.
Reaksi kesetimbangan antara hydrogen
dan Yod : reaksi berlangsung lambat pada suhu 300oC
menggunakan katalis Pt. reaksi bersifat dapat balik dan hanya sebagian yang
bereaksi.
H2 + I2 ↔ 2HI
Non logam halida
Halogen bereaksi dengan unsur-unsur non logam seperti C,
P, O, dan S membentuk senyawa non logam halida. Contoh non logam halida adalah
CCl4, PCl3, PF3, OF2, SCl2,
dan S2Cl2.
Contoh reaksi non logam
dengan halida adalah sebagai berikut:
Reaksi karbon dengan Clor :
reaksi memerlukan panas (bersifat endotermik)
C(s) + 2Cl2(g) → CCl4(l)
Reaksi fosfor dengan clor :
pemanasan bertahap fosfor dalam aliran lambat klorin menghasilkan PCl3.
2P(s) + 3Cl2(g) → 2PCl3(l)
Jika klorin yang direaksikan berlebih, maka akan dihasilkan padatan PCl5 dengan warna kuning pucat.
2P(s) + 5Cl2(g) → 2PCl5(s)
2. Reaksi halogen
dengan logam
Reaksi halogen dengan logam menghasilkan senyawa ionic. Contoh reaksi halogen dengan logam adalah
sebagai berikut:
Ca(s) + F2(g) → CaF2(s)
Fluorin bereaksi dengan air membentuk asam fluoride dengan reaksi sebagai berikut:
2F2(g) + H2O(g) ↔ 4HF(g) + O2(g)
Reaksi air dan fluorin berlangsung hebat karena air terbakar di dalam
fluorin.
Sementara halogen lainnya bereaksi dengan air melalui reaksi
disproporsionasi membentuk asam halide dan senyawa oksihalogen dengan reaksi
sebagai berikut:
X2 + H2O ↔ HOX + HX
Contoh reaksi halogen (kecuali F2) dengan air adalah sebagai
berikut:
Cl2 + H2O ↔ HOCl + HCl
Br2 + H2O ↔ HOBr + HBr
I2 + H2O ↔ HOI + HI
Halogen bereaksi dengan basa membentuk senyawa halida
yang kemudian mengalami reaksi disproporsionasi membentuk senyawa oksihalogen.
Berikut contoh reaksi halogen dengan basa:
Fluorin bereaksi dengan basa membentuk oksigen
difluorida OF2 dan ion fluoride F-, dengan reaksi
sebagai berikut:
2F2(g) + OH-(aq) → OF2(g) +
2F-(aq) + H2O(l)
Sedangkan klorin, bromine, dan iodine bereaksi dengan basa membentuk
ion hipohalit OX- dan ion halida X- dengan
reaksi sebagai berikut:
X2(g) + 2OH-(aq) → OX-(aq) +
X-(aq) + H2O(l)
Ion OX- yang terbentuk mengalami reaksi disproporsionasi membentuk
ion halat XO3- dan ion halida X-, dengan
reaksi sebagai berikut:
3OX-(aq) → XO3-(aq) +
2X-(aq)
Contoh reaksi halogen dengan basa adalah sebagai berikut:
Chlorine dan basa : ion OCl- yang
stabil pada suhu ruang akan terdisproporsionasi menjadi ClO3- jika
dipanaskan, reaksinya adalah sebagai berikut:
Cl2(g) + 2OH-(aq) → OCl-(aq) +
Cl-(aq) + H2O(l)
3OCl-(aq) → ClO3-(aq) +
2Cl-(aq)
Bromine dan basa : ion OBr- terdisproporsionasi
dengan cepat pada suhu ruang, reaksinya adalah sebagai berikut:
Br2(g) + 2OH-(aq) → OBr-(aq) +
Br-(aq) + H2O(l)
3OBr-(aq) → BrO3-(aq) +
2Br-(aq)
Iodine dan basa : ion OI- bereaksi sangat cepat,
sehingga sulit untuk diamati, reaksinya adalah sebagai berikut:
I2(g) + 2OH-(aq) → OI-(aq) +
I-(aq) + H2O(l)
3OI-(aq) → IO3-(aq) +
2I-(aq)
Reaksi antar halogen termasuk reaksi substitusi, membentuk senyawa antar halogen, dengan reaksi sebagai berikut:
X2 + Y2 → 2XY
Contoh reaksi antar halogen adalah sebagai berikut:
Cl2 + F2 → 2ClF
I2 + Cl2 → 2ICl
At2 + Br2 → 2AtBr
Unsur halogen dengan periode 3 ke atas (Cl, Br, I, At) dapat bereaksi
menurut persamaan reaksi berikut:
X2 + nY2 → 2XYn
Reaksi ini menghasilkan senyawa halogen dengan beberapa bilangan oksidasi.
Contoh reaksinya adalah sebagai berikut:
Biloks +3
Cl2 + 3F2 → 2ClF3
Biloks +5
Br2 + 5F2 → 2BrF5
Biloks +7
I2 + 7F2 → 2IF7
Terima kasih. Semoga bermanfaat J


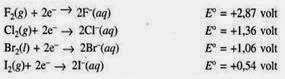























0 komentar:
Posting Komentar